摘要:论文《千岛湖流域典型河流附石生物膜反硝化潜力及其微生物群落特征分析》发表在《 环境科学学报 》,本文来自网络平台,仅供参考。 摘要 生物膜是在水生态系统中具有相对稳定性的微生
论文《千岛湖流域典型河流附石生物膜反硝化潜力及其微生物群落特征分析》发表在《环境科学学报》,本文来自网络平台,仅供参考。
摘要
生物膜是在水生态系统中具有相对稳定性的微生物及其代谢产物所组成的活性体系,在河流自净过程中发挥着重要的作用。为了探究千岛湖入湖河流砾石底质河床附石生物膜对水体氮素的脱除潜力及其影响因素,于2022-2023年选择典型河流开展了春、夏、秋、冬4个季节野外调查,研究了附石生物膜生物量与反硝化潜力的时空变化及其影响因素,并结合高通量测序技术分析了附石生物膜的微生物群落结构。结果表明,水体温度及营养盐水平是影响附石生物膜生物量的重要因素,温度最低的冬季附石生物膜生物量最低,营养盐浓度高的点位附石生物膜生物量较高。附石生物膜的生物量是决定其反硝化速率的重要因素,生物量的增加提高了反硝化速率。此外,附石生物膜的反硝化速率与水体温度、浊度呈显著正相关((r=0.46),(p<0.05);(r=0.49),(p<0.05)),与水体溶解氧呈显著负相关((r=-0.64),(p<0.01))。红细菌属(Rhodobacter)是附石生物膜的优势反硝化细菌属,不动杆菌属(Acinetobacter)、鞘氨醇单胞菌属(Sphingomonas)次之,氮浓度的增加以及温度的升高刺激了反硝化细菌的生长。
关键词
生物膜;反硝化;附石生物膜;千岛湖流域
Characterization of denitrification potential of epilithic biofilm and its microbial community in typical rivers of Lake Qiandao
WANG Yuanyi¹,², XU Hai¹,²,*, ZHANG Zining¹,³, QIU Yu¹,², WU Mingjie¹,³, SUN Hongwei¹,³, LIU Yuxing¹,³, ZHU Guangwei¹, ZHU Mengyuan¹, QIN Boqiang¹, ZHANG Yunlin¹
1. Key Laboratory of Lake and Basin Water Safety, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;2. University of Chinese Academy of Sciences, Beijing 100049, China;3. School of Environment and Ecology, Jiangnan University, Wuxi 214122, China
Abstract
Biofilm, consisting of relatively stable microorganisms and their metabolites, are integral in aquatic ecosystems, playing a significant role in the self-purification process of rivers. To explore the potential for nitrogen removal by periphyton attached to gravel bed substrate in the rivers flowing into Qiandao Lake and its influencing factors, spatiotemporal variation characteristics of water quality and periphyton biomass were invested from 2022 to 2023. Additionally, the denitrification potential of periphyton was measured through laboratory incubation experiments combined with membrane inlet mass spectrometry nitrogen-to-argon ratio analysis technology. High-throughput sequencing technology was employed to analyze the microbial community structure of the periphyton attached to stones. The results showed that water temperature and nutrient concentrations are important factors influencing the biomass of epilithic biofilm, with the lowest biomass in winter, and higher at nutrient-rich sites. The biomass of epilithic biofilm was an important factor in determining its denitrification rate, with higher biomass correlating with the enhanced denitrification rate. Furthermore, a significant positive correlation was found between the denitrification rate of epilithic biofilm and water temperature and turbidity((r=0.46),(p<0.05);(r=0.49),(p<0.05)), and a significant negative correlation with dissolved oxygen((r=-0.64),(p<0.01)). Rhodobacter was the dominant denitrifying bacterial genus in the epilithic biofilm, followed by Acinetobacter and Sphingomonas, and denitrifying bacteria were stimulated by increased nitrogen concentration and rising temperatures.
Key words
biofilm;denitrification;attached microorganisms;Lake Qiandao Basin
1 引言(Introduction)
近年来,农业面源氮素污染已逐步成为部分河流与湖泊等水体的首要污染指标,严重威胁水生生态系统健康稳定。硝酸盐具有较高的流动性,其被认为是流域内农业面源氮素污染的主要存在形式。高浓度硝态氮对水生植物和微生物具有毒性,长期饮用硝态氮超标的水也会引起严重的人类健康问题(Zhang et al., 2020b),水体中硝态氮浓度过高也会造成藻类的异常增殖,严重时会发生水华现象,可能会减少生物多样性,从而威胁淡水生态系统的结构和功能(Suna et al., 2018)。因此,硝酸盐控制与减排是水生态环境恢复中一个重要而具有挑战性的问题。
生物膜是微生物在地表环境中的主要聚集形式和栖息地(Flemming et al., 2019),广泛分布于土壤、海洋和淡水环境中。它是由细菌、真菌、藻类等多种微生物和一些原生动物、小型无脊椎动物及它们周边的细胞外多聚物(extracellular polymeric substances, EPS)共同组成的一个微型生态系统(Flemming et al., 2016)。在淡水水体中,生物膜主要存在于岩石、沉水植物等固体基质表面,强烈影响水体中以及水-固界面间物质的迁移转化和元素生物地球化学循环(姜星宇等, 2016)。大陆水系的氮循环过程通常与河岸带的功能有关,河流-地表水界面有助于氮转化的发生,而河床生物膜则是其中的主要贡献者(Trimmer et al., 2012),在河流硝化-反硝化等营养循环中起到关键作用(Mu et al., 2020)。一方面,生物膜中微生物的固氮作用是许多低营养湖泊不可或缺的氮来源。另一方面,在一些富营养化湖泊中,微生物介导的硝化与反硝化的耦合过程是氮去除的主要生物途径。研究表明,输入水生系统的氮在微生物的反硝化作用下可以去除30%~50%,而每年淡水系统(地下水、湖泊、河流)反硝化量约占全球反硝化总量的20%(Seitzinger et al., 2006)。
随着氮素面源污染问题的加剧(杨林章等, 2018),较多的研究着眼于自然水体中生物膜通过反硝化作用对氮素的去除转化效应,提高了水体的脱氮效率(Jasper et al., 2014)。Baldwin等(2006)在对河流生物膜的研究中发现,在生物膜丰富的地方,反硝化作用对硝酸盐的去除可达到50%。利用微藻生物膜处理城市污水的研究发现,连续光照条件下,生物膜对水体氮的去除速率可达到(1.0 ext{g}· ext{m}^{-2}· ext{d}^{-1})(Boelee et al., 2011)。Ishida等(2007)在池塘和湿地中布设底栖网,所得均匀生长的生物膜的反硝化潜力甚至高于底层沉积物。夏永秋等的实验表明,生物膜通过反硝化除氮的贡献介于水柱和沉积物之间,且水柱、生物膜和沉积物三者间存在强烈的交互作用,能较好的解释反硝化速率(Xia et al., 2018)。
生物膜的形成高度依赖周边环境,主要因素包括依附的基质类型、水文要素、营养盐浓度、生物因素及光照等物理环境因素。微生物细胞粘附与物体表面的初始附着强烈依赖于基质的表面性质(Murdock et al., 2007),主要是基质表面的粗糙度、颗粒物大小及气孔。基质表面的粗糙度会直接影响细胞与基质的粘附行为。水文条件也会调节微生物的营养来源,水流会不断将溶解氧和营养物质运输到生物膜表面,刺激细胞代谢,促进生物膜的生长以及对有机物质的消耗(Lyu et al., 2015),因此水流条件较快的情况下,一般会有更多的好氧细菌。但湍流条件下的水流的冲刷也会使外层粘附个体脱落,限制生物膜上细菌和藻类数目的增加(Arnon et al., 2007)。此外,较多的研究表明水体中营养盐的含量会影响生物膜上微生物生长和藻类的群落组成(Biggs et al., 1989; Su et al., 2017; Lu et al., 2018)。比如,在氮元素缺乏时,生物膜会出现较多的固氮微生物;而氮充足的条件下,生物膜则会具有较多的反硝化微生物和较高的硝酸还原酶活性。一般而言,当水体的营养水平较高时,生物膜的生物量较高(Ozkan et al., 2010),生物膜的生长速度也更快(李今, 2005)。富营养化和贫营养化湖泊中生物膜的微生物和藻类组成有明显的组成和结构差别(Raeder et al., 2010),富营养湖泊形成的生物膜相对较厚且不稳定(王文林等, 2014)。光照强度和温度是影响水体中生物膜的主要物理环境因素(Zhao et al., 2018)。光照会显著影响藻类的生长,在密闭的河流中,常常存在大量的丝状细菌、真菌或原生动物等异养生物,而在光照条件下充足的环境下,丝状或片状藻类的生物量占优势。温度制约着水中有机物质的溶解度、微生物生长速率和一系列的酶促反应(吴永红等, 2005),影响微生物的生长代谢。此外,水体中氧离子浓度、氧化还原电位也会使微生物数量存在一定的空间特异。
大量研究对生物膜开展了微生物层面的探究。自然淡水生物膜中存在变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)等具有反硝化作用的细菌(Fang et al., 2017; Li et al., 2019)。此外,在生物膜上也检测到了大量与反硝化作用相关的功能基因,如nirS、nirK和nosZ等(Vila-Costa et al., 2014; Li et al., 2019)。此外,影响河流生物膜内细菌群落的环境因素很多,如温度、pH、溶解性有机碳和土地利用方式等均与河流生物膜群落的变化有关。Lear等(2009)和Wang等(2011)的研究也揭示了不同土地利用方式下流域细菌群落组成的差异。
千岛湖是一个大型人工深水湖,是国家重点保护的饮用水源。进入千岛湖的河流数量众多,水文过程复杂,水质存在不同程度的污染(Han et al., 2013; Li et al., 2017),对河流区的治理对于湖区的水质保护具有重要意义。然而,入湖河流大多属于山区河流,河床由大量的砾石组成,故附着在砾石上的生物膜成为河流硝态氮去除的重要参与者。因此,探究河床附石生物膜的生态环境功能和氮的迁移转化等环境行为机制具有重要意义。基于此,本研究调查了千岛湖上游梓桐流域的现场水质理化参数,并采集了相应的砾石样品,通过培养实验培养测定流域河床附石生物膜的反硝化潜力,以阐明环境因子对梓桐的附石生物膜反硝化潜力的影响,同时结合高通量测序技术,从微生物群落组成角度探究附石生物膜的反硝化潜力。本研究对于探究山区河流砾石底质河床的氮素去除能力具有重要意义,可为流域氮素精确管理和湖泊水质富营养化管理目标提供科技支撑。
2 材料与方法(Materials and methods)
2.1 研究区域概况
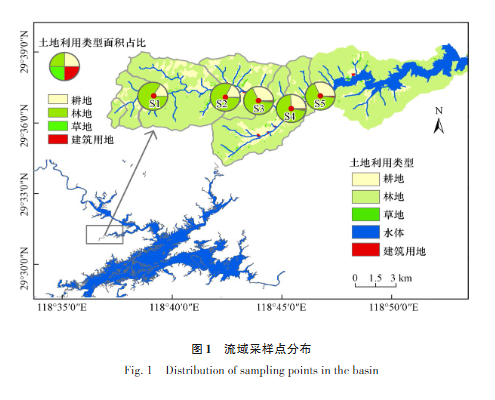
千岛湖(新安江水库)位于中国东南部,坝高105 m,长462 m,平均水深30.44 m。千岛湖典型蓄水位108 m,湖面面积(580 ext{km}^2),水量(178.4×10^8 ext{m}^3),流域面积达(10480 ext{km}^2)。水库主要接受周边多条河流的地表径流,包括新安江、富强溪、武强溪等(Zhang et al., 2019)。因此,对河流区的治理对于湖区的水质保护具有重要意义。鉴于千岛湖的入湖河流大多属于山区河流,河床由大量的砾石组成,故附着在砾石上的生物膜成为河流硝态氮去除的重要参与者。因此,探究河床附石生物膜的生态环境功能和氮的迁移转化机制具有重要意义。本研究选取梓桐源流域为研究对象,梓桐源发源于姜家镇与梓桐镇交界的夫畈岭,于梓桐码头流入千岛湖,主流长度为,集雨面积为(130.54 ext{km}^2)。从源头到入湖口布设了5个点位(图1),分别于2022年11月、2023年1月、2023年5月和2023年7月进行水样和附石生物膜样品的采集。
通过地理空间数据云(Geospatial Data Cloud, http://www.gscloud.cn/)收集千岛湖流域DEM的数字高程数据,通过GlobeLand30(http://www.globallandcover.com/)收集2020年的全球土地覆被数据。采样点位为各汇水区的出水口,以确保包括向各点供水的土地面积。使用ArcGis 10.7软件再次计算每个集水区内土地利用类型的百分比。
图1 流域采样点分布 Fig. 1 Distribution of sampling points in the basin
(注:图中展示了梓桐源流域5个采样点的空间分布,涵盖从源头到入湖口的不同区域,结合经纬度和土地利用类型标注)
2.2 数据收集与处理
2.2.1 水质数据
采集河流表层(水下0.5 m)水样后立即使用0.45 μm孔径的玻璃纤维滤膜(Whatman GF/F)过滤,使用连续流动分析仪(德国)测定滤后样品的(NO_3^--N)、(NO_2^--N)、(NH_4^+-N)和(PO_4^{3-})浓度,滤膜经过热乙醇提取后,利用分光光度法测定叶绿素(Chl a)含量;参照《水和废水分析方法》(SEPA, 2002)测定未过滤样品的总氮(TN)、总磷(TP)、溶解性总磷(DTP)和溶解性总氮(DTN)浓度。
2.2.2 附石生物膜生物量测定
将采集的砾石样品置于预清洗干净的聚氯乙烯瓶中,加入400 mL去离子水,超声振荡30 min。将振荡后的洗脱液负压经过两张0.45 μm孔径的玻璃纤维滤膜(Whatman GF/F)过滤,其中一张滤膜烘干恒重后之后置于马弗炉经过550 ℃燃烧4 h后称重,计算重量差得到附着生物膜的无灰干重(AFDM)。另一张滤膜经过热乙醇提取后,利用分光光度法测定叶绿素含量。
2.2.3 反硝化速率测定
将采集的砾石放入2 L的水袋中,加入1.5 L原水后排净空气,置于培养箱中避光培养24 h,设置培养箱温度与水体温度一致。分别于培养前后取水袋中的水,装入3支12 mL的Labco顶空瓶中,立即加入饱和氯化锌溶液((ZnCl_2))固定,采样结束后利用膜进样质谱仪(Membrane Inlet Mass Spectrometry, MIMS)测定Labco瓶内溶解性气体(N_2)的含量,通过培养前后的(N_2)差值计算沉积物中的潜在反硝化速率。
2.2.4 DNA提取、PCR扩增和测序
使用FastDNA®SPIN土壤试剂盒(MP biomedicals, Solon, OH, USA)提取生物膜总基因组DNA,并通过分光光度法(Tecan Spark, 瑞士)检测DNA的浓度和纯度。使用公认的338F/806R引物在细菌16S rRNA基因的V3-V4区域进行PCR扩增(Fadrosh et al., 2014)。PCR扩增条件参考Yu等(2023)的研究。使用AMPure XP纯化后,通过Illumina MiSeq平台对PCR产物进行测序后,生成片段长度为250 bp的双端读数。使用CLC微生物基因组学模块进行生物信息学分析,包括修剪引物序列、去除嵌合体、对操作分类单元(OTU)进行聚类、过滤低丰度OTU(<10个读数),并基于SILVA数据库对其进行分类信息分配。在微生物样品测定时,针对前期对于水质以及附着生物膜理化指标的测定以及分析结果,发现位于入湖口的S5点位指标波动较大,猜测该点位受到入湖口水量变化的影响比较大,因此对附着生物膜微生物检测时去除了该点位。
2.2.5 统计分析
使用Origin 9.1软件和SPSS统计软件进行数据分析。使用非参数Kruskal-Wallis检验比较独立组数据以评估它们之间的差异,如果p值小于0.05,则认为存在显著性差异。采用皮尔逊和斯皮尔曼相关系数评估各组数据之间的相关性,在本研究中,当P值小于0.05,相关系数r大于0.4,则认为两因素间有相关性且相关性具有显著的统计有效性。采用CANOCO 5(Microcomputer Power, Ithaca, NY, USA)进行冗余分析(RDA),探讨环境参数与生物膜群落组成之间的关系。
3 结果与分析(Results and analysis)
3.1 梓桐源水体理化指标时空变化特征
采样点的理化指标(水温、浊度、Chl a、电导率和溶解氧)变化如图2所示。河流四季的水温表现为夏季((21.69±1.31) ℃)>春季((18.82±0.83) ℃)>秋季((17.67±0.49) ℃)>冬季((15.00±1.09) ℃)。浊度的季节变化趋势和温度一致,表现为夏季(3.34±1.24)>春季(1.96±1.27)>秋季(1.76±2.20)>冬季(1.04±1.10),浊度在空间上从上游到下游逐渐增加,表现为S5(3.57±1.64)>S4(2.68±1.83)>S3(1.75±1.22)>S2(1.66±1.33)>S1(0.44±0.39)。Chl a浓度表现为秋季((1.02±0.85) μg·L⁻¹)>冬季((0.87±0.64) μg·L⁻¹)>春季((0.65±0.42) μg·L⁻¹)>夏季((0.48±0.09) μg·L⁻¹),在空间上也大致表现出从上游到下游逐渐增加的趋势,S1的浓度最低((0.12±0.04) μg·L⁻¹),S5的最高((1.89±1.47) μg·L⁻¹)。溶解氧浓度表现为秋季((10.31±0.78) mg·L⁻¹)>冬季((10.16±0.35) mg·L⁻¹)>春季((9.93±0.54) mg·L⁻¹)>夏季((9.42±0.61) mg·L⁻¹),空间上呈现出上游高下游低的趋势,浓度最低的点位为S4((9.39±0.51) mg·L⁻¹),其次是S5((9.54±1.10) mg·L⁻¹)。
图2 采样点理化指标的季节分布 Fig. 2 Seasonal distribution of physical and chemical indicators at sampling sites
(注:图中分别展示了春、夏、秋、冬四季各采样点的水温、浊度、Chl a、电导率和溶解氧的分布特征)
梓桐源水体氮浓度的时空分布如图3所示。从空间分布来看,除了冬季枯水期以外,梓桐流域从上游到下游呈现氮浓度增加的趋势,而在接近入湖口时,由于水量增大出现营养盐被稀释TN浓度小幅度降低的情况。冬季枯水期,流域TN浓度高值出现在上游区。从季节分布来看,流域TN浓度最高值出现在春季((2.76±0.31) mg·L⁻¹),夏季次之((2.15±0.28) mg·L⁻¹),秋季流域TN浓度最低((1.34±0.23) mg·L⁻¹)。水体中的氮主要以溶解态的形式存在,占比高达60.8%-98.5%,(NO_3^--N)为溶解态氮的主要成分,占比在70%以上。流域中(NO_2^--N)和(NH_4^+-N)的占比极低,分别占TN的0.1%~1.6%、0.1%~1.4%。
图3 采样点氮营养盐季节分布 Fig.3 Seasonal distribution of nitrogen nutrients at sampling sites
(注:图中分别展示了春、夏、秋、冬四季各采样点的TN、DTN、(NO_3^--N)、(NO_2^--N)、(NH_4^+-N)浓度分布)
3.2 附石生物膜时空分布特征
选取单位面积附石生物膜的AFDM和Chl a作为生物膜生物量的表征。附石生物膜生物量的时空变化如图4所示。AFDW和Chl a的整体变化趋势一致,从空间分布来看AFDW和Chl a的高值均出现在耕地占比较高的农田区,其中,春季AFDM和Chl a的高值出现在S3((6.47±1.60) g·m⁻²,(47.73±3.44) mg·m⁻²),夏季出现在S5((4.57±0.49) g·m⁻²,(36.01±4.35) mg·m⁻²),秋季出现在S4((9.19±0.81) g·m⁻²,(71.03±10.11) mg·m⁻²),冬季出现在S4((5.09±0.12) g·m⁻²,(24.18±2.23) mg·m⁻²)。从季节分布来看,春季的AFDW和Chl a最高((5.63±0.91) g·m⁻²,(44.2±17.22) mg·m⁻²),秋季次之((4.71±3.19) g·m⁻²,(34.06±25.43) mg·m⁻²)。夏冬两季的AFDW和Chl a较低,夏季分别为((3.06±1.04) g·m⁻²和(14.00±11.30) mg·m⁻²),冬季分别为((2.90±1.16) g·m⁻²和(15.87±4.72) mg·m⁻²)。
为探究流域河床附石生物膜的生物量与水体营养盐浓度之间的关系,将附石生物膜的AFDM和Chl a与TN、TP进行了相关性分析,分析结果如图5所示。除冬季枯水期以外,AFDM和Chl a与水体TN浓度均呈正相关,其中春秋两季AFDM与TN呈显著正相关((r=0.65),(p<0.05);(r=0.49),(p<0.05)),Chl a与TN也呈显著正相关((r=0.85),(p<0.05);(r=0.77),(p<0.01))。春夏两季TP浓度与AFDM和Chl a呈正相关,其中AFDM与TP在春夏两季均呈显著正相关((r=0.52),(p<0.05);(r=0.64),(p<0.05)),Chl a与TP在夏季呈显著正相关((r=0.67),(p<0.01))。
图4 附石生物膜生物量的季节分布 Fig. 4 Seasonal distribution of epilithic biofilm biomass
(注:图中分别展示了春、夏、秋、冬四季各采样点的AFDM和Chl a分布特征)
图5 附石生物膜生物量与氮磷营养盐的线性拟合关系 Fig. 5 Linear fit of epilithic biofilm biomass to nitrogen and phosphorus concentrations
(注:图中展示了不同季节附石生物膜AFDM、Chl a与TN、TP的线性相关关系及相关系数和显著性)
3.3 梓桐源附石生物膜的反硝化潜力
梓桐源附石生物膜的反硝化速率测定结果显示,不同季节不同点位之间附石生物膜的反硝化潜力不同(图6)。夏季附石生物膜反硝化潜力最高,为((7.25±2.56) μmol·m⁻²·h⁻¹),秋季次之,为((5.40±4.91) μmol·m⁻²·h⁻¹),冬季为((3.98±2.08) μmol·m⁻²·h⁻¹),春季反硝化速率最低,为((3.33±1.49) μmol·m⁻²·h⁻¹)。其中,秋季不同点位间附石生物膜反硝化速率差异较大,反硝化速率的最低值和最高值,分别出现在点位S1((0.55 μmol·m⁻²·h⁻¹)和S4((14.34 μmol·m⁻²·h⁻¹)。附石生物膜生物量与反硝化潜力的拟合结果如图6所示,反硝化潜力与AFDM和Chl a均呈显著正相关((r=0.53),(p<0.05);(r=0.49),(p<0.05))。
除了营养盐浓度外,附石生物膜反硝化速率受到多种环境因子的共同影响。将这些环境因子与反硝化速率进行了Spearman相关性分析,结果如表1所示,WT和NTU与反硝化速率呈显著正相关((r=0.46),(p<0.05);(r=0.49),(p<0.05)),DO与反硝化速率呈显著负相关((r=-0.64),(p<0.01))。
图6 附石生物膜反硝化潜力((Delta N_2))及其与生物量之间的线性拟合关系 Fig. 6 Denitrification potential of epilithic biofilms and its linear fit to biomass
(注:左图展示了各采样点不同季节的反硝化潜力分布,右图展示了反硝化潜力与AFDM、Chl a的线性相关关系)
表1 环境因子与附石生物膜反硝化速率的Spearman相关性分析 Table 1 Spearman's correlation analysis between environmental factors and denitrification rate of epilithic biofilm
| 项目 | 反硝化速率 | WT | DO | NTU | Chl a | EC |
|------|------------|----|----|-----|-------|----|
| 反硝化速率 | 1.00 | 0.46* | -0.64 | 0.49* | 0.26 | -0.03 |
| WT | 0.46* | 1.00 | -0.58 | 0.64 | 0.21 | 0.22 |
| DO | -0.64 | -0.58 | 1.00 | -0.51* | -0.29 | 0.18 |
| NTU | 0.49* | 0.64 | -0.51* | 1.00 | 0.55* | 0.03 |
| Chl a | 0.26 | 0.21 | -0.29 | 0.55* | 1.00 | -0.03 |
| EC | -0.03 | 0.22 | 0.18 | 0.03 | -0.03 | 1.00 |
注:(*p<0.05),(p<0.01)
3.4 附石生物膜微生物群落特征
在α多样性方面,不同季节和点位之间的Chao1指数值和Richness存在显著差异(图7)。夏季的Chao1指数和Richness指数最高,点位S3的Chao1指数和Richness指数值最低。β多样性分析显示,四季间以及点位间的细菌群落均存在显著差异(Anosim值,(p=0.001))。
图7 附石生物膜微生物群落的α多样性(a~d)和β多样性(e~f) Fig. 7 Alpha diversity(a~d)and beta diversity(e~f)of microbial communities in epilithic biofilms
(注:a~d分别展示了不同季节、不同点位的Chao1指数和Richness指数;e~f展示了基于MDS分析的微生物群落β多样性特征)
门水平上的细菌分类如图8所示,Others表示平均丰度小于1%的门水平上的细菌分类,优势菌门为变形菌门(Proteobacteria)(24.32%~62.18%)、蓝细菌(Cyanobacteria)(12.30%~48.36%)、拟杆菌门(Bacteroidetes)(4.54%~26.81%)、疣微菌门(Verrucomicrobia)(0.84%~17.01%)、浮霉菌门(Planctomycetes)(1.61%~11.14%)、酸杆菌门(Acidobacteria)(0.37%~11.22%)、厚壁菌门(Firmicutes)(0.21%~5.33%)和放线菌门(Actinobacteria)(0.36%~2.07%)。
图8 附石生物膜细菌群落门的相对丰度 Fig. 8 Relative abundance of epilithic biofilm bacterial community clades
(注:图中展示了春、夏、秋、冬四季各采样点细菌群落门水平的相对丰度分布)
占比前20的属的相对丰度如图9、表2所示,包含3个反硝化细菌属:红细菌属(Rhodobacter)(0.99%~8.95%)、不动杆菌属(Acinetobacter)(0.17%~7.57%)和鞘氨醇单胞菌属(Sphingomonas)(0.29%~3.73%)。所有生物膜样品中共监测出40个优势属(至少在一个生物膜样品中排前10),其中包含6个反硝化细菌属(图9),除了Rhodobacter、Acinetobacter和Sphingomonas,还包括黄杆菌属(Flavobacterium)(0.08%~2.24%)、嗜氢菌(Hydrogenophaga)(0.13%~1.25%)和芽孢杆菌(Bacillus)(0.02%~1.99%)。反硝化是自然生态系统中氮循环的重要一环。在本研究中,Rhodobacter是附石生物膜中最主要的反硝化细菌,其次是Acinetobacter。Rhodobacter在点位S4丰度最高,Acinetobacter在S1丰度最高,二者的丰度均在冬季占比最高。
图9 反硝化细菌属的相对丰度 Fig. 9 Relative abundance of denitrifying bacterial genera
(注:左图展示了各采样点反硝化细菌属的相对丰度,右图展示了不同季节反硝化细菌属的相对丰度)
表2 附石生物膜细菌群落优势属 Table 2 Relative abundance of dominant genera of epilithic biofilm bacterial communities
| 属 | 春季 | | | | 夏季 | | | | 秋季 | | | | 冬季 | | | |
|------|------|------|------|------|------|------|------|------|------|------|------|------|------|------|------|------|
| | S1 | S2 | S3 | S4 | S1 | S2 | S3 | S4 | S1 | S2 | S3 | S4 | S1 | S2 | S3 | S4 |
| Tychonema | 7.58 | 24.32 | 3.06 | 10.07 | 0.17 | 2.97 | 39.67 | 1.56 | 4.61 | 2.81 | 17.92 | 1.10 | 0.48 | 0.58 | 0.50 | 0.42 |
| Luteolibacter | 6.01 | 3.33 | 0.67 | 1.41 | 2.60 | 3.02 | 4.41 | 3.31 | 1.91 | 6.57 | 4.42 | 6.71 | 0.52 | 9.67 | 2.35 | 14.44 |
| Pleurocapsa | 2.02 | 4.25 | 2.98 | 0.92 | 2.78 | 1.59 | 4.13 | 0.39 | 1.08 | 1.12 | 6.98 | 2.20 | 0.08 | 0.46 | 0.06 | 2.65 |
| Rhodobacter | 5.31 | 1.29 | 4.71 | 3.84 | 4.17 | 1.20 | 7.77 | 2.44 | 6.45 | 2.43 | 2.17 | 1.83 | 1.37 | 8.95 | 0.99 | 1.03 |
| Pirellula | 1.84 | 3.72 | 2.16 | 2.99 | 2.56 | 3.22 | 0.44 | 1.67 | 3.39 | 1.11 | 0.72 | 6.04 | 5.64 | 5.19 | 5.27 | 6.28 |
| Acinetobacter | 7.57 | 0.25 | 0.17 | 0.24 | 4.99 | 0.43 | 0.27 | 0.26 | 0.94 | 0.54 | 1.84 | 1.24 | 2.69 | 3.79 | 5.67 | 5.57 |
| Blastocatella | 0.42 | 9.43 | 0.11 | 0.52 | 0.15 | 6.66 | 0.65 | 0.88 | 5.31 | 6.65 | 1.64 | 0.19 | 2.90 | 0.30 | 0.59 | 0.14 |
| Aliterella | 0.04 | 4.18 | 0.73 | 0.46 | 0.05 | 2.30 | 4.24 | 0.23 | 0.36 | 13.57 | 3.75 | 0.13 | 0.50 | 0.11 | 0.43 | 0.10 |
| AAP99 | 0.58 | 0.96 | 0.87 | 0.64 | 2.94 | 2.93 | 1.35 | 1.13 | 0.20 | 0.63 | 0.47 | 2.64 | 2.12 | 5.29 | 2.28 | 3.42 |
| Flavisolibacter | 0.10 | 5.72 | 0.07 | 0.35 | 0.09 | 4.30 | 6.49 | 0.93 | 1.45 | 4.41 | 2.67 | 0.09 | 0.95 | 0.07 | 0.12 | 0.07 |
| Sphingorhabdus | 1.26 | 8.43 | 3.02 | 0.88 | 2.12 | 1.88 | 0.93 | 0.37 | 0.36 | 0.54 | 0.77 | 0.41 | 0.46 | 0.81 | 0.29 | 0.35 |
| Porphyrobacter | 0.29 | 2.15 | 2.50 | 0.83 | 0.79 | 3.14 | 1.10 | 0.48 | 1.68 | 0.37 | 0.48 | 0.46 | 2.00 | 0.57 | 4.88 | 0.85 |
| Hymenobacter | 0.09 | 3.85 | 0.23 | 0.11 | 0.11 | 0.28 | 2.69 | 0.12 | 0.28 | 3.76 | 7.78 | 0.06 | 1.45 | 0.12 | 0.19 | 0.11 |
| Sphingomonas | 0.56 | 3.73 | 0.48 | 0.67 | 0.75 | 2.55 | 2.59 | 0.85 | 1.44 | 2.49 | 2.47 | 0.30 | 0.84 | 0.55 | 0.29 | 0.38 |
| Brevundimonas | 3.84 | 1.83 | 0.88 | 0.69 | 0.44 | 1.50 | 2.04 | 0.32 | 1.24 | 0.64 | 4.31 | 0.35 | 0.66 | 0.78 | 0.41 | 0.41 |
| Tabrizicola | 0.42 | 1.02 | 0.40 | 1.23 | 0.37 | 2.02 | 0.72 | 1.36 | 1.06 | 0.31 | 0.51 | 1.05 | 1.29 | 0.99 | 0.89 | 1.04 |
| Dinghuibacter | 0.20 | 0.62 | 1.00 | 2.41 | 0.22 | 1.44 | 0.51 | 1.70 | 0.89 | 0.45 | 0.28 | 1.50 | 0.98 | 0.58 | 1.00 | 0.33 |
| Pseudorhodobacter | 0.41 | 0.19 | 1.01 | 0.31 | 2.15 | 0.33 | 0.13 | 0.19 | 0.16 | 0.15 | 0.18 | 2.36 | 0.45 | 2.29 | 0.74 | 2.06 |
| Limnohabitans | 0.86 | 0.09 | 1.92 | 0.52 | 0.43 | 0.19 | 0.12 | 0.19 | 0.96 | 0.30 | 0.35 | 0.50 | 2.33 | 1.57 | 1.49 | 0.85 |
| Others | 78.46 | 37.49 | 43.57 | 71.36 | 73.38 | 54.39 | 32.89 | 75.36 | 57.65 | 35.65 | 47.97 | 53.73 | 55.61 | 59.20 | 59.88 | 45.90 |
将反硝化细菌属与反硝化速率进行Spearman相关性分析,发现反硝化速率与Rhodobacter的相对丰度呈显著正相关((p<0.05),(r=0.58)),与其他反硝化细菌属无显著相关性。采用RDA方法描述了环境参数与附石生物膜优势属的关系(图10),结果显示反硝化细菌Rhodobacter与总氮浓度呈正相关,此外,EC、pH、NTU等环境因子也是影响反硝化细菌的因素。
图10 环境因子与优势属之间的冗余分析 Fig. 10 Redundancy analysis between environmental factors and dominant genera
(注:图中展示了环境因子(WT、DO、NTU、TN等)与优势细菌属之间的冗余分析结果,箭头方向表示相关性趋势,长度表示影响程度)
4 讨论(Discussion)
4.1 梓桐源水体理化指标时空变化原因分析
浊度在季节上表现为夏季>春季>秋季>冬季,在空间上表现为从上游到下游逐渐增加,主要与降雨和人类活动有关。梓桐源处于亚热带季风气候区,年均降水量约1733 mm,3-5月为春汛期,6-7月为主汛期,枯水期为10月-翌年2月(赵星辰等, 2022)。春夏两季大量的降雨冲刷增加了支流周边的土壤侵蚀,大量颗粒物进入流域,造成春夏两季水体浊度较高。下游点位耕地面积占比大,农业活动对土壤扰动频繁,导致表层土壤结构松散(陆淑宁等, 2024),受到的侵蚀程度更高,颗粒物更易进入水体,导致下游点位的浊度高于耕地面积占比较低的上游点位。
溶解氧浓度在季节上表现为秋季>冬季>春季>夏季,在空间上表现为上游高、下游低。秋冬季水体中的生物活动较弱,溶解氧主要受温度影响,并且此时温度较低,氧气在水体中的溶解度较大。虽然春夏两季浮游植物大量增殖依靠光合作用产生氧气,但此时温度升高,降低了氧气的溶解度,造成氧气逸出(刘瑞娟等, 2023)。此外,春夏两季降雨集中,降雨径流携带营养盐进入接收水体影响水质,养分负荷的增加促进了藻类增殖,藻类生物量过高降低了流域的溶解氧水平(Zhang et al., 2015)。因此相较于秋冬季节,春夏季节的溶解氧含量有所降低。由于下游点位集水区耕地和居民区占比更高,带来了更多的营养盐输入,造成浮游植物大量繁殖降低水体溶解氧水平(Shi et al., 2023)。
梓桐流域氮营养盐浓度主要集中在春夏两季,从空间分布来看,除了冬季枯水期以外,呈现从上游到下游增加的趋势。与浊度的变化一致,由于春夏两季降雨集中,流域居民区及耕地区的人类活动导致大量营养盐随降雨径流进入水体中,提高了春夏两季的营养盐浓度。而下游耕地区及居民区的占比更高,导致了下游水体营养盐浓度更高。此外,Chl a浓度在空间上也大致表现出从上游到下游逐渐增加的趋势,这是因为营养盐是藻类生长的一个重要影响因素,营养盐浓度的增加会引起藻类的增殖(Suna et al., 2018),因此下游点位的Chl a浓度更高。
4.2 附石生物膜形成的影响因素
在本研究中,附石生物膜生物量(AFDM和Chl a)在时间和空间上都存在着差异,这是由于生物膜的生长受到不同环境因子的影响(Lu et al., 2018; Zhao et al., 2018; Zheng et al., 2022)。相关研究表明,水体中的营养盐水平是影响附石生物膜生物量的一个重要因素。当营养盐水平较高时,生物膜的生物量较高,生物膜生长水平也较快,导致附石生物膜生物量的差异。Teissier等(2002)的研究表明当河流流经大型城市之后,生物膜的生物量明显升高;Artigas等(2015)探究不同营养盐水平对河流生物膜结构和活性的影响显示,氮磷浓度降低,生物膜细菌密度和Chl a也降低。本研究对附石生物膜的AFDM和Chl a与梓桐流域水体TN和TP的相关性分析结果表明,除冬季枯水期以外,AFDM和Chl a与水体TN浓度均呈正相关,并且春秋两季的TN浓度与AFMDM和Chl a均呈显著正相关。春夏两季的TP浓度与AFDM和Chl a呈显著正相关。从空间上看,下游点位(S3、S4和S5)的耕地占比和建筑用地占比更高,活跃的农业活动和人类生活导致流域营养盐浓度相对较高,因此其附石生物膜的生物量也相对较高。
除营养盐水平外,温度是影响生物膜的重要环境因素之一。相关研究表明,较高的温度条件下,附石生物膜的厚度较高,其Chl a和胞外聚合物(EPS)的含量也较高。温度过高或过低都会限制藻类的生长,相较于高温来说,低温更不利于附着生物膜藻类的生长(Zhao et al., 2018)。Rosa等(2013)对影响附石生物膜呼吸作用的探究表明,水温升高能刺激附石生物膜生物量的增加,进而刺激其呼吸作用。本研究中,水体春、夏、秋、冬四季的平均温度分别为(18.82±0.83)、(21.69±1.31)、(17.67±0.49)和(15.00±1.09) ℃,因此,冬季附石生物膜生物量最低的原因之一可能是冬季的水体温度最低,使藻类生长受到限制。
4.3 附石生物膜反硝化潜力影响因素
流域附石生物膜的生物量是影响反硝化潜力的重要因素,Teissier等(2002)对法国加隆河河床砾石附石生物膜的研究表明,生物膜生物量与其在黑暗条件下的反硝化速率之间呈现出非常显著的正相关关系。Lyautey等(2013)对光氧河流天然生物膜的研究表明,附石生物膜反硝化酶活性与AFDM呈显著正相关,且两者之间呈指数分布关系。本研究的相关性分析结果也表明附石生物膜生物量与反硝化速率呈显著正相关。附石生物膜生物量的最高值出现在秋季的S4点位,AFDM和Chl a分别为(9.19±0.81) g·m⁻²和(71.03±10.11) mg·m⁻²,而反硝化速率最高值也出现在秋季的S4点位,为14.34 μmol·m⁻²·h⁻¹。
附石生物膜反硝化速率还受多种环境因素的影响。Spearman相关分析显示,WT和NTU与反硝化速率呈显著正相关,DO与反硝化速率呈显著负相关。温度是控制反硝化过程的重要因素,它通过影响参与反硝化底物水解和硝酸盐还原过程的酶的活性来控制反硝化过程。在低温条件下,碳源水解效率和反硝化菌的活性均下降,导致反硝化速率下降(Wang et al., 2016)。Bouletreau等(2012)的研究表明,光氧河流附石生物膜的反硝化过程对温度有较强的依赖性,温度较高的处理组生物膜的反硝化活性也更强。由于反硝化微生物以兼性厌氧细菌为主,反硝化过程一般发生在低氧或厌氧的条件(Ghafari et al., 2008; Wang et al., 2016),因此DO的升高不利于附石生物膜反硝化过程的进行,Kemp等(2002)的研究也表明,当生境缺氧时,河流基质的反硝化作用会显著增强。此外,NTU与反硝化速率呈显著正相关,NTU的增加表征着水体悬浮物质的增加。一方面,悬浮物中含有有机碳,可以为反硝化过程提供电子,因此悬浮物的增加提高了反硝化速率(Zhang et al., 2020a)。另一方面,悬浮物的增加会增强上覆水的硝化作用,由此产生的硝酸盐供应增加,进而导致河床反硝化作用的加强(Xia et al., 2017)。
4.4 附石生物膜微生物群落季节变化
基于物种相对丰度分析了微生物α多样性和β多样性特征(图7),结果显示,附石生物膜微生物α多样性在不同季节和不同点位之间存在显著差异,β多样性分析结果也表明不同季节和点位之间附石生物膜微生物群落之间存在差异。Chao1指数和Richness指数均显示夏季的群落丰富度最高,冬季最低,这可能因为微生物群落受水体温度的影响,夏季水体能满足大多数细菌的动力区温度且有利于细菌生长繁殖,冬季低温则对细菌的生长繁殖产生抑制作用(冯胜等, 2006; 胡鹏等, 2019; 丁宁等, 2023)。此外,由于夏季降雨量较大,地表径流携带大量陆生微生物进入水体,导致微生物群落丰度较高(Mansfeldt et al., 2020)。点位S3的α多样性最低,可能是由于点位S3附近的耕地和城镇用地占比最高,排放的污染物包含了大量的营养盐。研究表明,硝酸盐的富集会显著降低狐尾藻附着生物膜细菌群落的α多样性(张松贺, 2021),在本研究中,除冬季枯水期以外,S3点位的(NO_3^--N)浓度也最高。
本研究在附石生物膜中共检测出6种优势反硝化细菌属,其中Rhodobacter是最主要的反硝化细菌,Acinetobacter次之,相关研究也表明Rhodobacter和Acinetobacter是附着生物膜的优势反硝化细菌(Idi et al., 2015; Pang et al., 2016; 张松贺, 2021)。6种反硝化细菌属相对丰度与反硝化速率的Spearman相关性分析显示,反硝化速率与Rhodobacter呈显著正相关,表明Rhodobacter是附石生物膜反硝化的主要贡献者。这可能由于Rhodobacter多属于光合细菌,包括光合自养(厌氧型)、光合异养(厌氧/光照)或化学异养(需氧)型(马强等, 2011)。由于该河流水深较浅,光照充足,有助于可利用多种有机化合物作为碳源和电子供体在厌氧/好氧条件下进行光异养/自养生长的红杆菌属(Rhodobacter)在此成为优势菌种(杨文焕等, 2020)。研究发现Flavobacterium、Pseudomonas、Hydrogenophaga、Acinetobacter、Rhizobium、Deftia等反硝化菌属偏好营养相对贫瘠的水生生境(芦燕等, 2019)。Acinetobacter尽管在极端低温条件下也具有较高且稳定的氨氮代谢能力(Zhao et al., 2021)。因此,Acinetobacter存在于营养盐浓度相对较低的S1点位,并且在温度较低的冬季相对丰度更高。
根据反硝化细菌群落结构和沉积物理化因子的冗余分析(RDA)可知,总氮与反硝化优势菌属Rhodobacter呈正相关(图10),有关研究也表明Rhodobacter的丰度随着硝酸盐负荷的增加而增加(Zhang et al., 2020b)。温度也对反硝化过程产生影响,WT与Sphingomonas呈正相关,主要因为Sphingomonas在28 ℃时具有较好的生长状态(Chen et al., 2013),而本研究中流域的WT分布在13.56~23.88 ℃,对反硝化作用的促进随温度的升高而增强。
5 结论(Conclusions)
1)千岛湖典型砾石底质入湖河附石生物膜存在明显的时空变化特征。空间上,附石生物膜的AFDM和Chla的高值出现在耕地占比较高的农田区,时间上,春季的AFDM和Chla最高((5.63±0.91) g·m⁻²,(44.2±17.22) mg·m⁻²),冬季最低((2.90±1.16) g·m⁻²,(15.87±4.72) mg·m⁻²)。
2)附石生物膜反硝化潜力受河流水环境因素影响。附石生物膜反硝化潜力受生物量的影响,与AFDM和Chl a均呈显著正相关((r=0.53),(p<0.05);(r=0.49),(p<0.05))。此外,水体温度和浊度的增加都会增加其反硝化速率,溶解氧的增加会降低其反硝化速率。
3)Rhodobacter是附石生物膜最主要的反硝化细菌,是反硝化过程的主要贡献者。高通量测序结果显示Rhodobacter、Acinetobacter、Sphingomonas、Flavobacterium、Hydrogenophaga和Bacillus是附石生物膜的优势反硝化细菌属,其中,Rhodobacter是最主要的反硝化细菌,是反硝化过程的主要贡献者。反硝化细菌属的相对丰度受环境因子的影响,水体氮营养盐的增加和温度的升高均刺激了反硝化细菌的生长。
参考文献(References)
[1] Artigas J, Romaní A M, Sabater S. 2015. Nutrient and enzymatic adaptations of stream biofilms to changes in nitrogen and phosphorus supply[J]. Aquatic Microbial Ecology, 75(2): 91-102.
[2] Boelee N C, Temmink H, Janssen M, et al. 2011. Nitrogen and phosphorus removal from municipal wastewater effluent using microalgal biofilms[J]. Water Research, 45(18): 5925-5933.
[3] Bouletreau S, Salvo E, Lyautey E, et al. 2012. Temperature dependence of denitrification in phototrophic river biofilms[J]. Science of the Total Environment, 416: 323-328.
[4] Chen H, Jogler M, Tindall B J, et al. 2013. Sphingomonas starnbergensis sp. nov., isolated from a prealpine freshwater lake[J]. International Journal of Systematic and Evolutionary Microbiology, 63(Pt_3): 1017-1023.
[5] 丁宁, 杨莹莹, 万年新, 等. 2023. 调蓄水库细菌群落季节变化特征与影响因素[J]. 环境科学, 44(3): 1484-1496.
[6] Fadrosh D W, Ma B, Gajer P, et al. 2014. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform[J]. Microbiome, 2: 6.
[7] Fang H W, Chen Y S, Huang L, et al. 2017. Analysis of biofilm bacterial communities under different shear stresses using size-fractionated sediment[J]. Scientific Reports, 7: 1299.
[8] 冯胜, 高光, 秦伯强, 等. 2006. 太湖北部湖区水体中浮游细菌的动态变化[J]. 湖泊科学, 18(6): 636-642.
[9] Flemming H-C, Wuertz S. 2019. Bacteria and archaea on Earth and their abundance in biofilms[J]. Nature Reviews Microbiology, 17(4): 247-260.
[10] Flemming H C, Wingender J, Szewzyk U, et al. 2016. Biofilms: an emergent form of bacterial life[J]. Nat Rev Microbiol, 14(9): 563-575.
[11] Ghafari S, Hasan M, Aroua M K. 2008. Bio-electrochemical removal of nitrate from water and wastewater-A review[J]. Bioresource Technology, 99(10): 3965-3974.
[12] Han X X, Zhu G W, Wu Z X, et al. 2013. Spatial-temporal variations of water quality parameters in Xin'anjiang Reservoir (Lake Qiandao) and the water protection strategy[J]. Journal of Lake Sciences, 25(6): 836-845.
[13] 胡鹏, 杨庆, 杨泽凡, 等. 2019. 水体中溶解氧含量与其物理影响因素的实验研究[J]. 水利学报, 50(6): 679-686.
[14] Idi A, Ibrahim Z, Mohamad S E, et al. 2015. Biokinetics of nitrogen removal at high concentrations by Rhodobacter sphaeroides ADZ101[J]. International Biodeterioration & Biodegradation, 105: 245-251.
[15] Ishida C K, Arnon S, Peterson C G, et al. 2007. Influence of algal community structure on denitrification rates in periphyton cultivated on artificial substrata[J]. Microbial Ecology, 56(1): 140-152.
[16] Jasper J T, Jones Z L, Sharp J O, et al. 2014. Nitrate removal in shallow, open-water treatment wetlands[J]. Environmental Science & Technology, 48(19): 11512-11520.
[17] 姜星宇, 姚晓龙, 徐会显, 等. 2016. 长江中下游典型湿地沉积物-水界面硝酸盐异养还原过程[J]. 湖泊科学, 28(6): 1283-1292.
[18] Kemp M J, Dodds W K. 2002. The influence of ammonium, nitrate, and dissolved oxygen concentrations on uptake, nitrification, and denitrification rates associated with prairie stream substrata[J]. Limnology and Oceanography, 47(5): 1380-1393.
[19] Lear G, Boothroyd I K G, Turner S J, et al. 2009. A comparison of bacteria and benthic invertebrates as indicators of ecological health in streams[J]. Freshwater Biology, 54(7): 1532-1543.
[20] Li C H, Zheng X K, Zhao F, et al. 2017. Effects of urban non-point source pollution from baoding city on Baiyangdian Lake, China[J]. Water, 9(4): 249.
[21] Li S S, Peng C R, Cheng T S, et al. 2019. Nitrogen-cycling microbial community functional potential and enzyme activities in cultured biofilms with response to inorganic nitrogen availability[J]. Journal of Environment Science, 76: 89-99.
[22] Li Y, Zhang Y L, Shi K, et al. 2018. Spatiotemporal dynamics of chlorophyll-a in a large reservoir as derived from Landsat 8 OLI data: Understanding its driving and restrictive factors[J]. Environmental Science and Pollution Research, 25(2): 1359-1374.
[23] 刘瑞娟, 陈思杨, 余骏, 等. 2023. 浙江近岸海域溶解氧的时空分布特征[J]. 海洋开发与管理, 40(4): 13-20.
[24] Lu H Y, Qi W C, Liu J, et al. 2018. Paddy periphyton: Potential roles for salt and nutrient management in degraded mudflats from coastal reclamation[J]. Land Degradation & Development, 29(9): 2932-2941.
[25] 芦燕, 曾静, 赵吉, 等. 2019. 典型草原区不同生境反硝化菌群的空间特征[J]. 微生物学通报, 46(4): 707-720.
[26] 陆淑宁, 李荣融, 姚冲, 等. 2024. 横坡垄作对坡耕地产流产沙及氮磷养分流失过程影响研究[J]. 土壤学报, 61(5): 1271-1283.
[27] Lyautey E, Hallin S, Teissier S, et al. 2013. Abundance, activity and structure of denitrifier communities in phototrophic river biofilms (River Garonne, France)[J]. Hydrobiologia, 716(1): 177-187.
[28] Mansfeldt C, Deiner K, Mächler E, et al. 2020. Microbial community shifts in streams receiving treated wastewater effluent[J]. Science of The Total Environment, 709: 135727.
[29] 马强, 高明瑜, 谭伟, 等. 2011. 新型生态浮岛在改善水质中的作用及生物膜载体微生物特征研究[J]. 环境科学, 32(6): 1596-1601.
[30] Mu X Y, Lv X Y, Liu W, et al. 2020. Biofilms attached to Myriophyllum spicatum play a dominant role in nitrogen removal in constructed wetland mesocosms with submersed macrophytes: Evidence from 15N tracking, nitrogen budgets and metagenomics analyses[J]. Environmental Pollution, 266: 115203.
[31] Pang S, Zhang S H, Lv X Y, et al. 2016. Characterization of bacterial community in biofilm and sediments of wetlands dominated by aquatic macrophytes[J]. Ecological Engineering, 97: 242-250.
[32] Rosa J, Ferreira V, Canhoto C, et al. 2013. Combined effects of water temperature and nutrients concentration on periphyton respiration – implications of global change[J]. International Review of Hydrobiology, 98(1): 14-23.
[33] Seitzinger S, Harrison J A, Bohlke J K, et al. 2006. Denitrification across landscapes and waterscapes:: A synthesis[J]. Ecological Applications, 16(6): 2064-2090.
[34] SEPA C. 2002. Methods for monitoring and analysis of water and wastewater, 4th ed[M]. Beijing: China Environmental Science Press.
[35] Shi P C, Zhu M Y, You R F, et al. 2023. Rainstorm events trigger algal blooms in a large oligotrophic reservoir[J]. Journal of Hydrology, 622: 129711.
[36] Suna H M, Yang Z C, Wei C J, et al. 2018. Nitrogen removal performance and functional genes distribution patterns in solid-phase denitrification subsurface constructed wetland with micro aeration[J]. Bioresource Technology, 263: 223-231.
[37] Teissier S, Garabetian F, Torre M, et al. 2002. Impact of an urban centre on the nitrogen cycle processes of epilithic biofilms during a summer lowwater period[J]. River Research and Applications, 18(1): 21-30.
[38] Trimmer M, Grey J, Heppell C M, et al. 2012. River bed carbon and nitrogen cycling: state of play and some new directions[J]. Science of the Total Environment, 434: 143-158.
[39] Vila-Costa M, Bartrons M, Catalan J, et al. 2014. Nitrogen-cycling genes in epilithic biofilms of oligotrophic high-altitude lakes (central Pyrenees, Spain)[J]. Microbial Ecology, 68(1): 60-69.
[40] Wang J L, Chu L B. 2016. Biological nitrate removal from water and wastewater by solid-phase denitrification process[J]. Biotechnology Advances, 34(6): 1103-1112.
[41] Wang S Y, Sudduth E B, Wallenstein M D, et al. 2011. Watershed urbanization alters the composition and function of stream bacterial communities[J]. PLoS One, 6(8): e22972.
[42] Xia X H, Liu T, Yang Z F, et al. 2017. Enhanced nitrogen loss from rivers through coupled nitrification-denitrification caused by suspended sediment[J]. Science of the Total Environment, 579: 47-59.
[43] Xia Y Q, She D L, Zhang W J, et al. 2018. Improving Denitrification Models by Including Bacterial and Periphytic Biofilm in a Shallow Water‐Sediment System[J]. Water Resources Research, 54(10): 8146-8159.
[44] 杨林章, 吴永红. 2018. 农业面源污染防控与水环境保护[J]. 中国科学院院刊, 33(2): 168-176.
[45] 杨文焕, 石大钧, 张元, 等. 2020. 高原





